近日,Bioresource Technology在线发表了江南大学糖化学与生物技术教育部重点实验室刘龙教授课题组的研究成果“Highly efficient neutralizer-free L -malic acid production using engineeredSaccharomyces cerevisiae” (Sunet al.,Bioresource Technology, 2023. 370: 128580)。江南大学2018级博士生孙利为论文第一作者,刘龙教授为论文通讯作者。作为一种重要的化学品原料,有机酸广泛应用于生物医药、食品添加剂和材料化学等行业。近年来,微生物发酵法生产有机酸成为一种很有前景的生产方法。然而,在微生物发酵有机酸的生产过程中,随着其自身酸性产品的积累,导致发酵液pH的不断下降(通常低于3.0),严重影响了细胞的代谢活性和生产效率。目前,工业上解决此类问题的主要办法是在生产过程中添加大量中和剂(如碳酸钙、碳酸镁、氢氧化钠或氨水等),这不仅增加了下游分离纯化工艺的难度,提高了生产成本,还会造成严重的环境污染。因此,如何选育可耐受低pH (<3.0)的微生物进而实现无(或少)中和剂的添加是长期以来有机酸发酵工业亟需解决的一个关键难题和挑战。针对上述关键难题,该研究以酿酒酵母(Saccharomyces cerevisiae)为出发菌株,首先以L-苹果酸和柠檬酸为选择压力,通过近1800代实验室适应性进化与筛选,选育了一株可耐受pH 2.3的酿酒酵母突变株TAMC (图1)。通过对耐酸酿酒酵母TAMC酸耐受的多样性进行分析,发现该突变株具有较强的耐酸广谱性,可耐受L-苹果酸、柠檬酸、L-乳酸、丙酮酸、富马酸、葡萄糖酸、衣康酸、琥珀酸和丙酸等多种有机酸(图2)。在此基础上,以耐酸酿酒酵母TAMC为底盘细胞,通过代谢途径重构、转运体工程等策略,实现了L-苹果酸的高效合成。首先,对酿酒酵母中L-苹果酸合成效率最高的胞质途径进行调控,通过强化关键基因、解除葡萄糖抑制等策略,摇瓶上L-苹果酸的产量较出发菌株提高5.6倍,达到7.3 g/L(图3)。并进一步引入了粟酒裂殖酵母(Schizosaccharomyces pombe)来源的L-苹果酸转运蛋白SpMae1,L-苹果酸产量提高至24 g/L,但胞内仍有5.8 g/L的累积(图4)。为提高胞内L-苹果酸的外排效率,基于L-苹果酸响应系统对L-苹果酸转运体进行了改造,成功筛选出一个可显著提高L-苹果酸胞外转运效率的突变体SpMae1F253A,L-苹果酸的胞外产量提升至73.6 g/L(图4)。此外,对突变体的转运机制进行了分析,发现转运蛋白突变体转运效率的提高可能与转运通道体积的扩大有关(图5)。最后,优化前体物质丙酮酸的代谢流,L-苹果酸的摇瓶产量达到81.8 g/L。在3-L发酵罐上进行分批补料发酵,在不添加中和剂的条件下,L-苹果酸的产量达到232.9 g/L (目前报道的苹果酸最高产量),转化率为0.66 g/g葡萄糖,生产强度为1.62 g/L/h,发酵结束时pH为2.8左右(图6)。该研究所选育的耐酸酿酒酵母菌株在其它种类有机酸的工业发酵生产中也具有较大的应用潜力。上述研究工作得到了国家重点研发项目(2021YFD2101000/2021YFD2101002)、国家自然科学基金(32021005,32100439,32070085)、中央高校基本科研专项资金(JUSRP622004,JUSRP222007)等项目的资助。
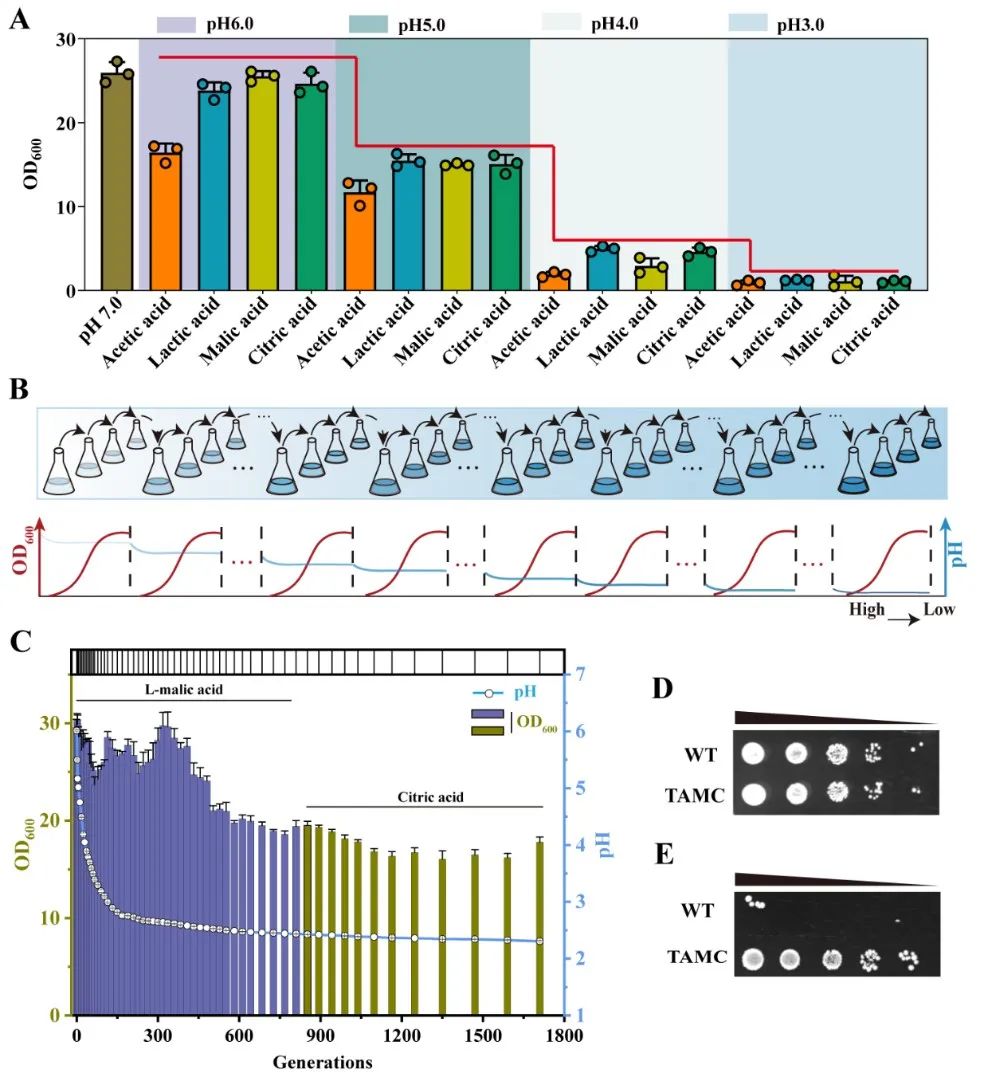
图1耐酸酿酒酵母的进化与筛选
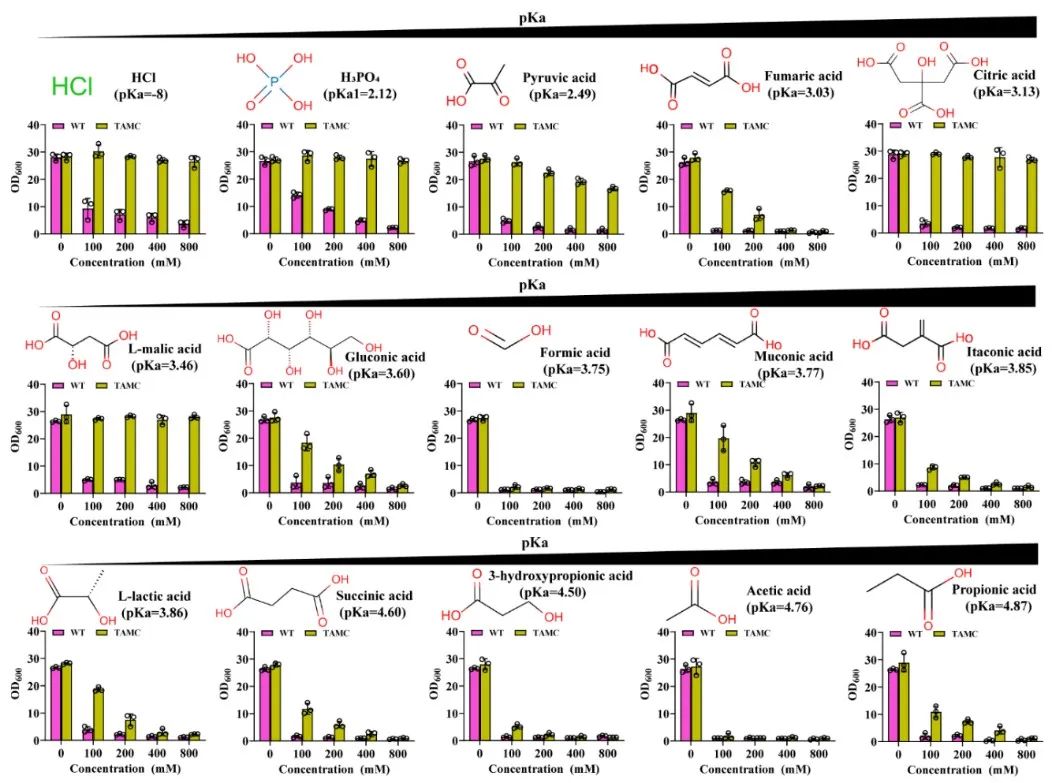
图2耐酸酿酒酵母耐酸广谱性分析
图3 L-苹果酸胞质合成途径的代谢调控
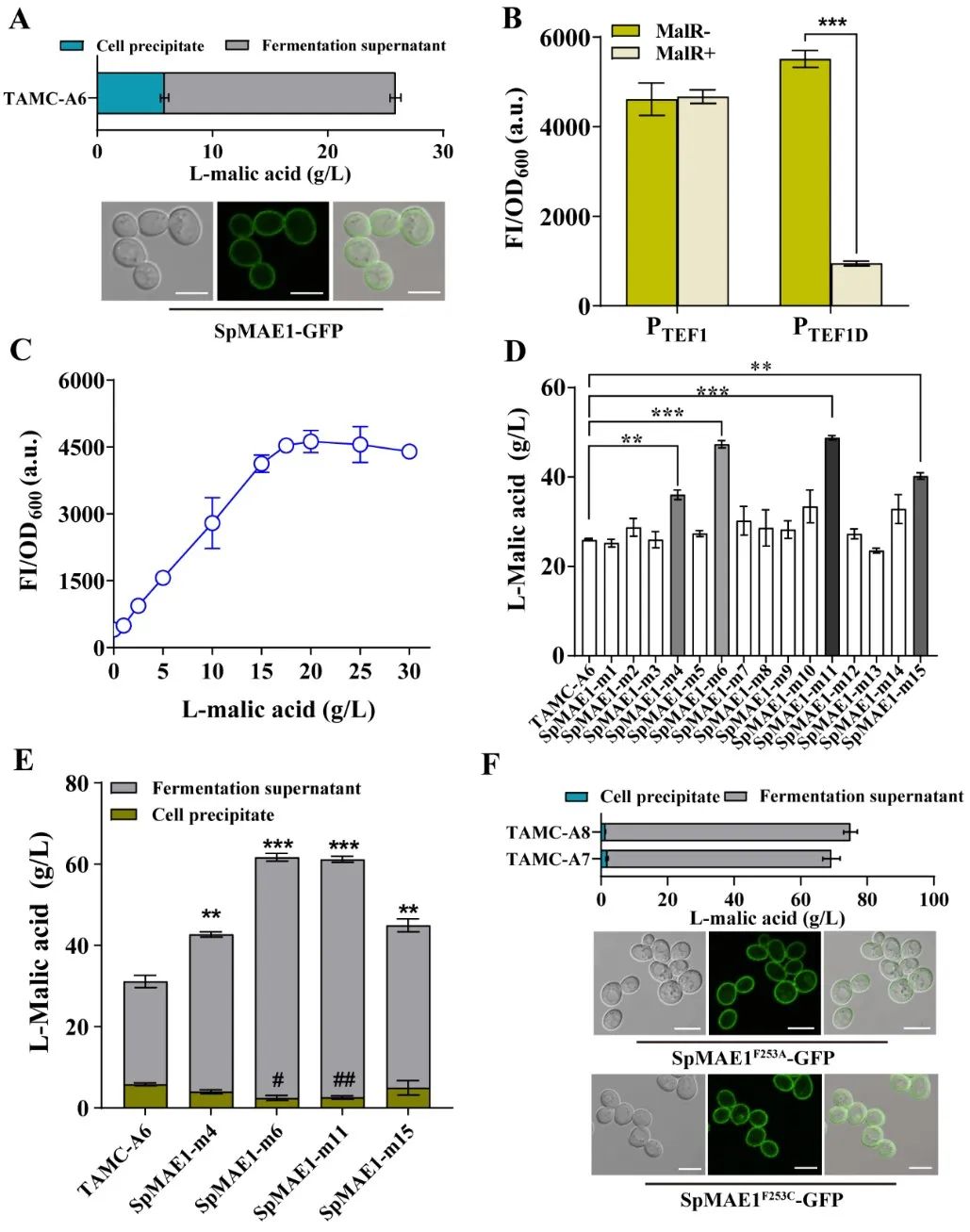
图4 L-苹果酸转运体的改造与调控
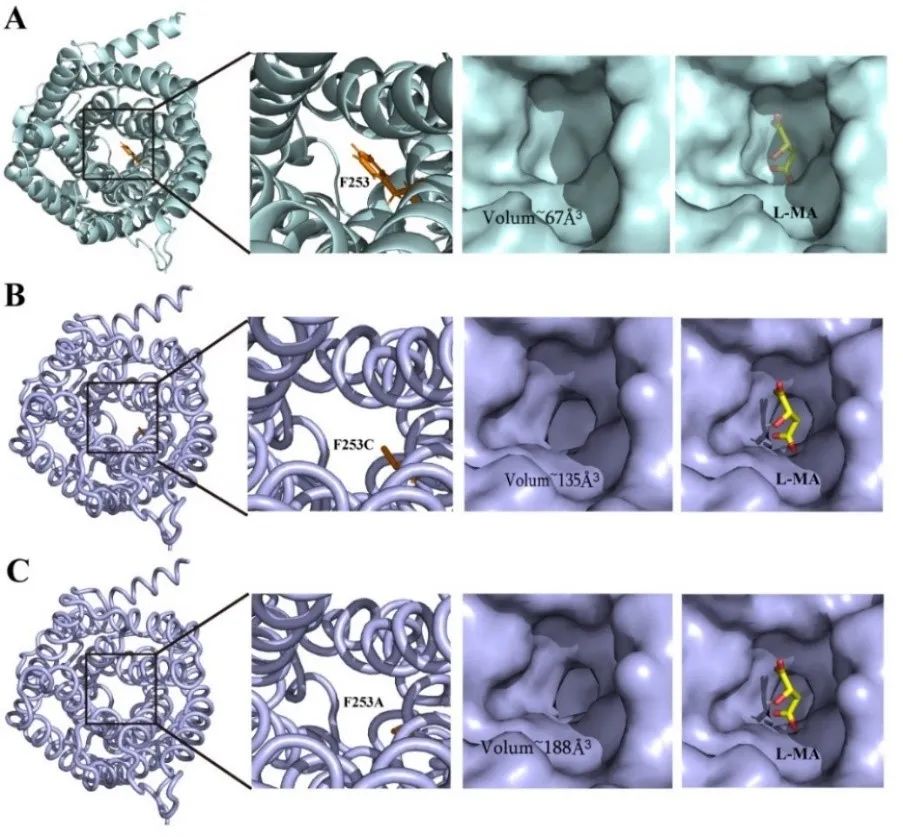
图5 L-苹果酸转运蛋白及其突变体的结构预测与分析
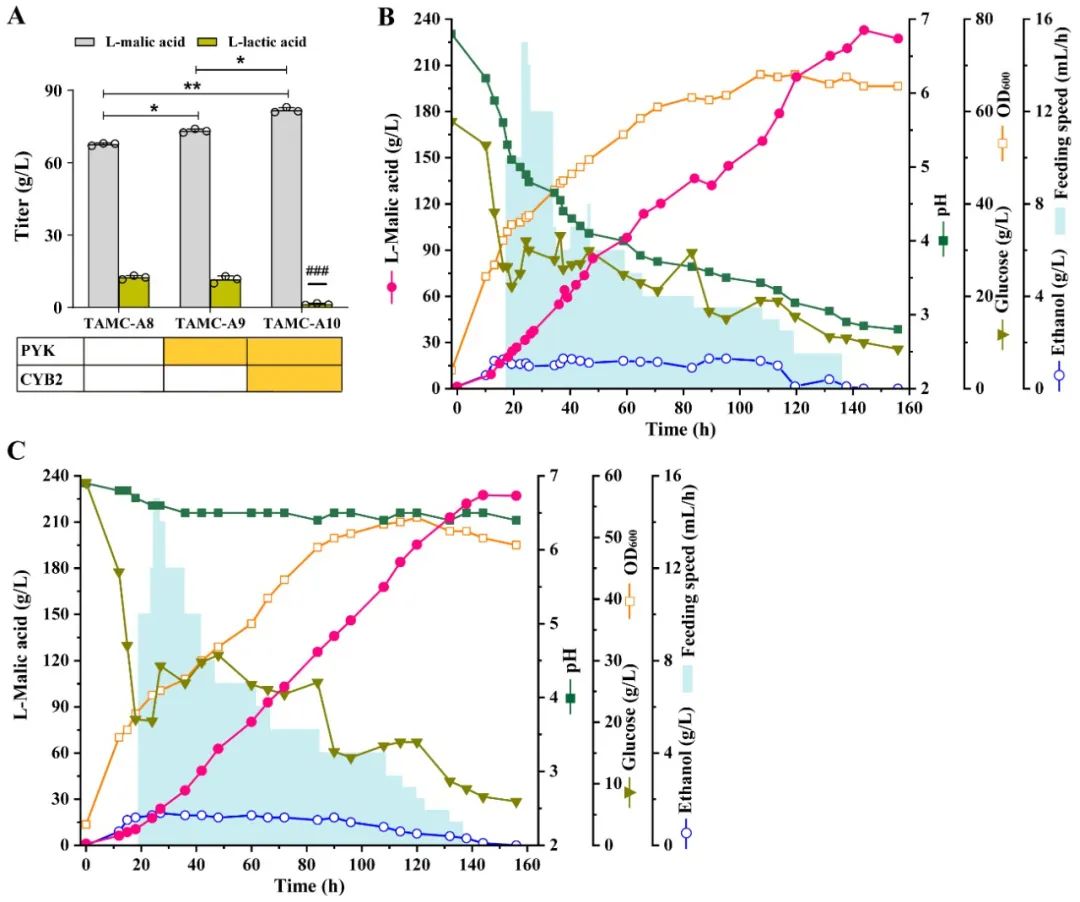
图6 L-苹果酸合成前体的代谢流优化及3-L发酵罐分批补料发酵
